国家和地方政府出台相应政策,鼓励发挥当地技术优势和植物资源优势,引导本地化妆品特色植物原料的开发和利用。不久前,三部委印发《轻工业稳增长工作方案(2023—2024年)》,明确指出加强特色植物原料开发创新,加大在化妆品等行业的应用。相信未来会有更多植物原料想要尝试申报化妆品新原料。
然而,不同于其他类型的原料,植物原料的来源和工艺都决定了其具有成分复杂、结构不唯一的特点。那么,企业在进行化妆品新原料注册/备案时,需要关注哪些方面呢?『 妆研24小时 』已梳理好相关内容,一起来看:
01 植物基本信息
植物来源的新原料首先应当明确植物的基本信息,包括:
通用名称、拉丁名、种属名称、物种鉴定依据(专业人员或专业机构出具的鉴定报告)、使用部位、产地或收集地信息、野生或种植信息等。
02 植物来源新原料的命名
植物来源的原料命名时,建议按《国际化妆品原料标准中文名称目录》的原则进行命名。
直接植物来源原料
直接来源于植物的新原料应按照“中文名○拉丁学名○使用部位○使用形式”的格式命名,包含其来源植物的拉丁学名及其使用部位。
从目前公示的备案原料来看,大部分原料是按照此命名形式进行命名的。
举例
平卧菊三七(GYNURA PROCUMBENS)提取物(国妆原备字 20230013 号),根据公示的生产工艺信息,该原料是平卧菊三七全株进行提取;
大叶冬青(ILEX LATIFOLIA)叶提取物(国妆原备字 20230021 号),原料名称中明确植物拉丁名及使用部位信息。
间接植物来源原料
间接来源于植物的新原料在命名时需根据具体的情况描述。
举例
冰叶日中花(MESEMBRYANTHEMUM CRYSTALLINUM)愈伤组织提取物(国妆原备字 20230017 号),是经过植物组织培养得到的新原料。
03 植物来源原料的组成
植物来源的原料一般是由多种组分组成的天然混合物,最常见的是以提取物形式存在。
以植物提取物为例,这类原料无法像结构明确的化合物一样说明其纯度或含量指标,但应当说明新原料主要化学成分或特征性成分(如多酚类、黄酮类、多糖类、多肽类、皂苷类等)。
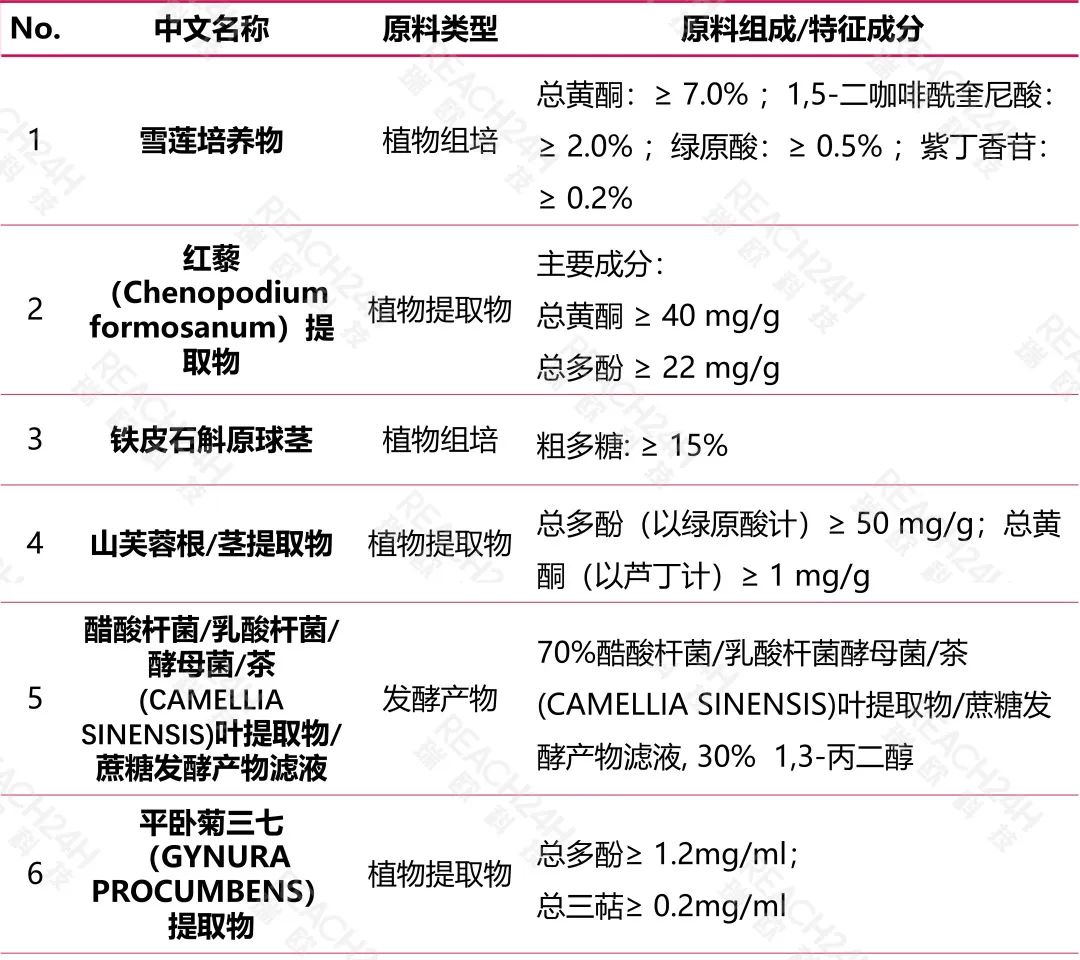
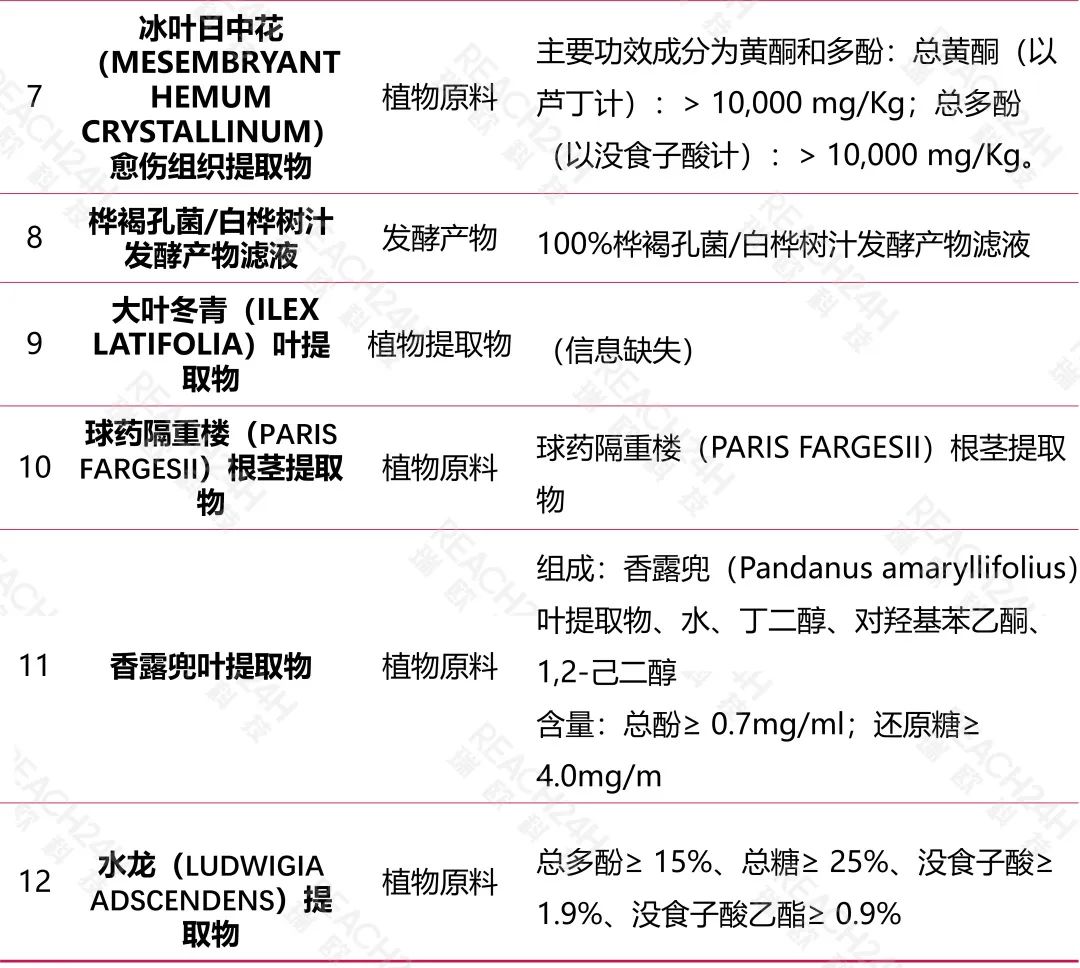
此外,需注意植物提取物一般以粉末或浸膏形式存在,若因技术上不可避免添加助剂的,还需明确添加的助剂(如溶剂、防腐剂、稳定剂等)相关信息。
04 植物来源原料的农残风险
大多数植物在生长过程、生长环境中会或多或少接触农药,因此植物来源的原料需要关注是否存在农药残留的风险。
国家市场监督管理总局在 2020 年 12 月发布的国家标准 GB/T 39665-2020《含植物提取物类化妆品中 55 种禁用农药残留量的测定》,可以作为检测农药残留的参考测试方法。
05 植物原料应提供的毒理学资料
需要注意的是,并没有专门针对植物原料的毒理学资料要求,原料的资料要求仍然取决于所属情形:
即原料的使用目的(是否属于防腐、防晒、着色、染发、祛斑美白、防脱发、祛痘、非物理性抗皱、去屑、除臭功能)、生物活性、人群使用历史(是否有在境外已上市化妆品中有三年以上安全使用历史、是否有安全食用历史)等。
5种情形
除了聚合物之外,新原料可以属于以下 5 种情形的任意一种:
情形1:国内外首次使用的中高风险原料及具有较高生物活性的原料;
情形2:国内外首次使用的低风险原料
情形3:在境外上市化妆品中已有三年以上安全使用历史的低风险原料;
情形4:在境外上市化妆品中已有三年以上安全使用历史的中高风险原料;
情形5:具有安全食用历史的原料(原料所使用的部位应与食用部位一致)。
注:
中高风险:具有防腐、防晒、着色、染发、祛斑美白、防脱发、祛痘、抗皱(物理性抗皱除外)、去屑、除臭功能。
低风险:不具有防腐、防晒、着色、染发、祛斑美白、防脱发、祛痘、抗皱(物理性抗皱除外)、去屑、除臭功能
毒理学试验资料要求
具体的毒理学试验项目资料要求见下表:
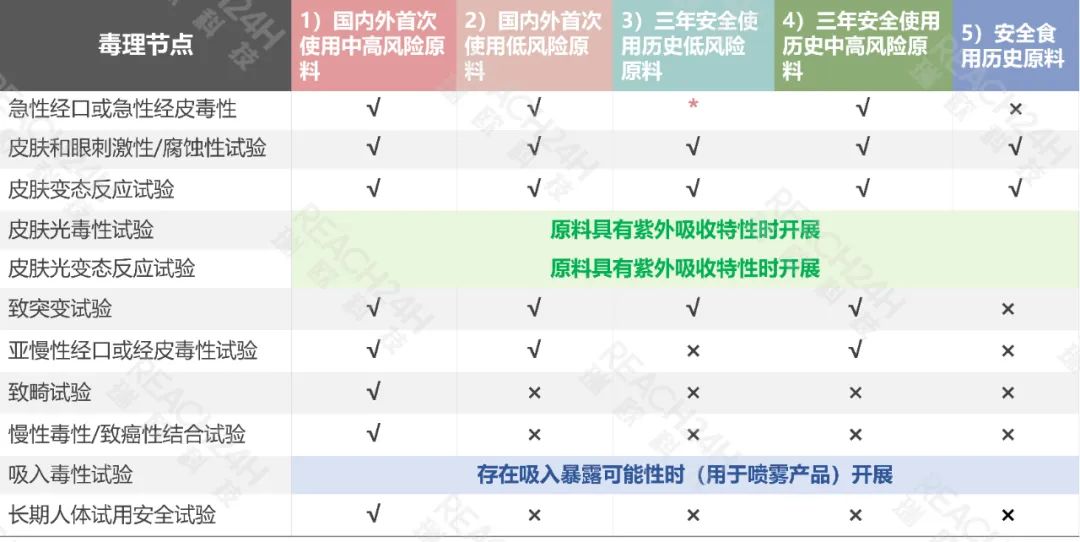
*若能够同时提供国际权威安全评价机构评价结论认为在化妆品中使用是安全的安全评估报告,或符合伦理学条件下的人体安全性检验报告的,可不提交急性经口或急性经皮毒性试验。
高风险原料要求
纳米原料:情形 1 + 各项毒理学试验方法适用于纳米原料检测的适用性说明 + 皮肤吸收/透皮吸收试验资料(拟用于皮肤部位)
国内外首次使用的具较高生物活性的寡肽/多肽/蛋白质类原料:情形 1 + 皮肤吸收/透皮试验和免疫毒性试验资料
国内外首次使用的具健康危害效应(局部毒性除外)的原料:情形 1 + 毒物代谢及动力学试验资料
举例
例 1 :国内外首次使用的低风险原料(情形 2 )应当提交上述第 1~7 项毒理学试验资料:1.急性经口或急性经皮毒性试验;2.皮肤和眼刺激性/腐蚀性试验;3.皮肤变态反应试验;4.皮肤光毒性试验(原料具有紫外线吸收特性需做该项试验);5.皮肤光变态反应试验(原料具有紫外线吸收特性需做该项试验);6.致突变试验(至少应当包括一项基因突变试验和一项染色体畸变试验);7.亚慢性经口或经皮毒性试验(如果该原料在化妆品中使用经口摄入可能性大时,应当提供亚慢性经口毒性试验);
例 2 :安全食用历史原料(情形 5 )应当提交上述第2~5项毒理学试验资料:2.皮肤和眼刺激性/腐蚀性试验;3.皮肤变态反应试验;4.皮肤光毒性试验(原料具有紫外线吸收特性需做该项试验);5.皮肤光变态反应试验(原料具有紫外线吸收特性需做该项试验);
使用替代方法
在选择具体的毒理学测试方法时,为了减少动物试验,可以选择替代方法,在下一篇中,我们将详细介绍如何减少化妆品新原料中的动物测试。
在使用替代方法时需注意,OECD 指南中的替代方法大多针对单一化合物或有明确组分浓度的混合物,而植物类原料通常是多种组分组成的复杂混合物,在涉及体外替代方法时需注意方法的适用性。
例如:体外皮肤变态反应直接多肽反应试验 - DPRA 方法,该方法不能用于复杂未知组成的混合物、未知可变单一物质、复杂反应产物以及生物材料,因此植物来源原料可能不适用于 DPRA 方法。
植物来源新原料在进行毒理学替代方法试验时,方法的适用性也是需要重点考察和关注的内容。
免责声明:本文转载自《妆研24小时》公众号,如有侵权,请联系删除。文章内容仅供参考,不构成投资建议。投资者据此操作,风险自担, 关于对文中陈述、观点判断保持中立,不对所包含内容的准确性、可靠性或完整性提供任何明示或暗示的保证。


